Гаптичність

Гаптичність (англ. hapticity) — координування суміжних атомів у ліганді центральним металічним атомом у комплексних сполуках.
Символ гапто ηn використовується для позначення гаптичності при зв'язуванні вуглеводнів (агостичні взаємодії) та інших π-електронних систем з металами, де степінь n позначає кількість атомів ліганду, зв'язаних з центральним атомом.[1]
Якщо ж центральний атом металу зв'заний з кількома несуміжними атомами, тоді мова йде про дентатність.
Потреба у цій термінології з'явилася в середині 1950-х, коли за допомогою рентгеноструктурного аналізу була вперше описана структура «сендвічної сполуки», фероцену.[2] Ф. А. Коттон запропонував термін «гаптичність», що походив від префіксу «гапто-» (від грец. haptein — «контакт» чи «комбінація»).[3]
Історично значимі сполуки з гаптичними лігандами:
- фероцен, біс(η5-циклопентадієн)заліза.
- ураноцен, біс(η8−1,3,5,7-циклооктатетраєн)урану.
- W(CO)3(PPri3)2(η2-H2) — перша сполука синтетизована з молекулою водню H2 як ліганд.[4]
- IrCl(CO)[P(C6H5)3]2(η2-O2) — сполука, що містить молекулу кисню O2, і що оборотно формується при окисненні комплексу Васки (транс-карбонілхлоробіс(трифенілфосфін)іридію(I), з формулою IrCl(CO)[P(C6H5)3]2).
Гаптичність ліганда може змінюватися протягом реакції. Наприклад, у наступній окисно-відновній реакції відбувається зміна від η6-бензену до η4-бензену:[5]
Гаптичність може змінюватися і в ході реакції заміщення. У наступній реакції, η5-циклопентадієн змінюється до η3-циклопентадієну, звільнюючи місце у комплексі для додаткової пари електронів ліганду 'L'. Видалення однієї молекули CO та віддача двох електронів циклопентадієновим лігандом відновлює η5-циклопентадієн:
Так званий, інденіловий ефект[en] описує зміну гаптичності ліганду в реакціях заміщення.
Необхідно розрізняти терміни «гаптичність» і «дентатність».
Дентатність: полідентатні ліганди координуються до атому металу через кілька несуміжних атомів. Тоді, використовується позначення κ («каппа»)[6] Наприклад, при координації 1,2-біс(дифенілфосфіно)етану до NiCl2 формується дихлоро[етан-1,2-діїлбіс(дифенілфосфан)-κ2P]|нікелю(ІІ).
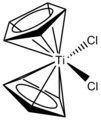
Гаптичність: якщо атоми, що координуються, є суміжними використовується позначення η («ета»). Наприклад, в титаноцен дихлориді, дихлоробіс(η5−2,4-циклопентадієн-1-іл)титанію.[7]
-
Термін «дентатність» використовується, наприклад, для дихлоро[етан-1,2-діїлбіс(діфенілфосфан)-κ2P]нікелю(ІІ)
-
Термін «гаптичність» використовується, наприклад, для дихлоробіс(η5−2,4-циклопентадієн-1-іл)титанію

Полігаптичні молекули є часто структуромінливими. Два типи мінливих структур є найбільш характерними для полігаптичних комплексів:
- Тип 1: коли гаптичність ліганду є нижчою від числа sp2-атомів карбону. У такому випадку, метал часто мігруватиме від одного карбону до іншого, зберігаючи при цьому ту ж гаптичність. Так атом заліза почергово зв'язується з кожним атомом карбону в η1-C5H5 ліганді в (η5-C5H5)Fe(η1-C5H5)(CO)2 комплексі.[8] Використовуючи термінологію органічної хімії, реакція є вироджена, і є прикладом сигматропного перегрупування. Подібним прикладом є біс(циклооктатетраєн)заліза, що містить кільця η4- і η6-C8H8.[9]
- Тип 2: коли комплекс містить циклічний полігаптичний ліганд максимальної гаптичності. Такі ліганди зазнають обертання. Відомим прикладом є фероцен, Fe(η5-C5H5)2,[10] в якому циклопентадієн має низький енергетичний бар'єр обертання.
- ↑ η (eta or hapto) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.) . Архів оригіналу за 20 лютого 2017. Процитовано 28.09.2020.
- ↑ J. Dunitz; L. Orgel; A. Rich (1956). The crystal structure of ferrocene. Acta Crystallographica. 9 (4): 373—5. doi:10.1107/S0365110X56001091.
- ↑ F. Albert Cotton (1968). Proposed nomenclature for olefin-metal and other organometallic complexes. J. Am. Chem. Soc. 90 (22): 6230—6232.
- ↑ Kubas, Gregory J. (1 березня 1988). Molecular hydrogen complexes: coordination of a .sigma. bond to transition metals. Accounts of Chemical Research. Т. 21, № 3. с. 120—128. doi:10.1021/ar00147a005. ISSN 0001-4842. Процитовано 28 вересня 2020.
- ↑ Huttner, Gottfried; Lange, Siegfried; Fischer, Ernst O. (1971). Molecular Structure of Bis(Hexamethylbenzene)-Ruthenium(0). Angewandte Chemie International Edition in English. 10 (8): 556—557. doi:10.1002/anie.197105561.
- ↑ κ (kappa) in inorganic nomenclature. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.) . 28.09.2020. Архів оригіналу за 14 серпня 2020.
- ↑ IR-9.2.4.1 Coordination Compounds: Describing the Constitution of Coordination Compounds: Specifying donor atoms: General. Nomenclature of Inorganic Chemistry – Recommendations 1990 (the 'Red Book') (вид. Draft March 2004). IUPAC. 2004. с. 16. Архів оригіналу (PDF) за 3 серпня 2016. Процитовано 28 вересня 2020.
- ↑ O'Connor, Joseph M.; Casey, Charles P. (1 квітня 1987). Ring-slippage chemistry of transition metal cyclopentadienyl and indenyl complexes. Chemical Reviews. Т. 87, № 2. с. 307—318. doi:10.1021/cr00078a002. ISSN 0009-2665. Архів оригіналу за 29 травня 2020. Процитовано 28 вересня 2020.
- ↑ Carbonaro, A.; Segre, A. L.; Greco, A.; Tosi, C.; Dall'Asta, G. (1 липня 1968). Oligomerization catalysts. II. Spectroscopic examination of bis(cyclooctatetraene)iron. Journal of the American Chemical Society. Т. 90, № 16. с. 4453—4455. doi:10.1021/ja01018a045. ISSN 0002-7863. Процитовано 28 вересня 2020.
- ↑ Bunker, P.R. (1965). The Vibrational Selection Rules and Torsional Barrier of Ferrocene. Molecular Physics. 9 (3): 247—255. doi:10.1080/00268976500100321.
- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.


![Термін «дентатність» використовується, наприклад, для дихлоро[етан-1,2-діїлбіс(діфенілфосфан)-κ2P]нікелю(ІІ)](http://upload.wikimedia.org/wikipedia/commons/thumb/6/61/DppeNiCl2.png/193px-DppeNiCl2.png)